En nuestro medio ambiente encontramos elementos químicos vitales tales como:
- Hidrógeno (H)
- Oxígeno (O)
- Carbono (C)
Los dos primeros elementos al unirse forman la molécula del agua (H2O); los dos últimos elementos al unirse forman la molécula del dióxido de carbono (CO2).
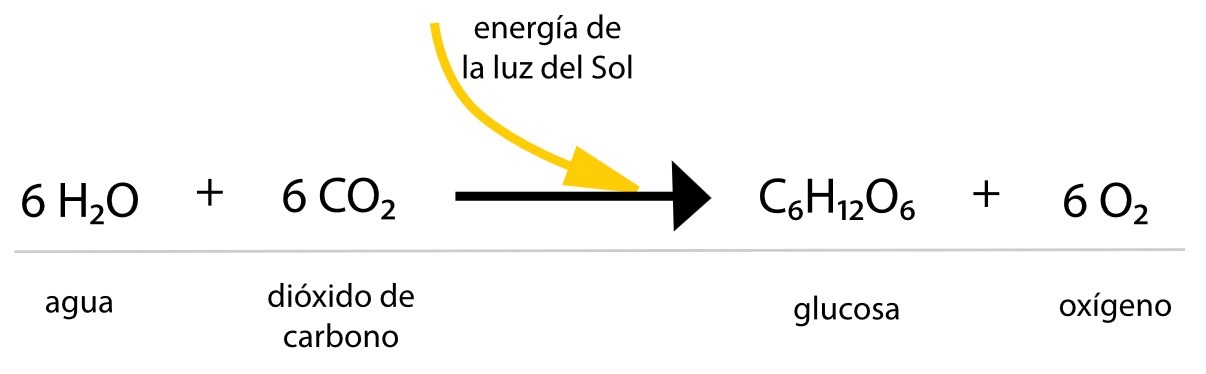
El sol es la fuente de energía de la que depende la vida en nuestro planeta. Solo aquellos organismos que contienen clorofila, como las algas azules y verdes, el plancton y el gran numero de las plantas superiores, son capaces de utilizar la energía solar en sus procesos vitales; esto se lleva a cabo gracias a la fotosíntesis, que se explica en la siguiente ecuación química.
Balance de ecuación química de la fotosíntesis:
Todos los animales viven gracias a la respiración, proceso contrario de la anterior ecuación, donde se queman los hidratos de carbono con el oxígeno, formando dióxido de carbono y agua, y utilizando la energía que se libera para sus procesos vitales. Se puede representar de la siguiente manera:
Además de estos componentes químicos, los organismos vivos contienen algunos elementos que son parte integrante de los compuestos químicos que se sintetizan como el material estructural, y los usan en sus procesos vitales. Entre los mas importantes podemos citar:
- Nitrógeno (N)
- Fósforo (P)
- Azufre (S)
- Sodio (Na)
- Potasio (K)
- Calcio (Ca)
- Manganeso (Mn)
- Magnesio (Mg)
- Hierro (Fe)
- Cobalto (Co)
- Cobre (Cu)
- Zinc (Zn)
- Cloro (Cl)




![clip_image001[9] clip_image001[9]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEjZTMKc2NkCYbtEsPKNhQVzxz4UUvOBDq_vsX3dxtAdyjUxk5rveExzu4bjp5CJpCX72U1e4rvHfjEadHHJjUnLoMSb4xV0e_wlZyVeS6iAStw8SsSbWKugPwpYTE8KhkZbwE6fvtaSzhE/?imgmax=800)
![clip_image001[11] clip_image001[11]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEhE2K-IMCFZe80aaudV8TCuZqMgP6aXX3Ts07ckGjH0EzFkWcAP6_2mkRq20D70LSY-ljgT_Ole9QH5229S4R6wZkAt3HcbB1St2g_-RlfLPbDTRmbFywhDVza16M8kdiz7u7hUuWF9ITk/?imgmax=800)








