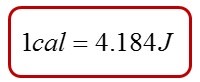La unidad del Sistema Internacional SI es el Joule (J) (se pronuncia “yul”), en honor de James Prescott Joule (1818-1889), un científico británico que investigó el trabajo y el calor.
Ejemplo 1: Una masa de 2 kg que se mueve a una velocidad de 1 m/s posee una energía cinética de 1 J.
Un joule no es una gran cantidad de energía, por eso con frecuencia usaremos kilojoules (kJ) al hablar de la energía asociada a las reacciones químicas.
Tradicionalmente, los cambios de energía que acompañan a las reacciones químicas se expresaban en calorías, unidad que no pertenece al SI, pero que todavía se usa ampliamente en química, biología y bioquímica. Originalmente, una caloría(cal) se definía como la cantidad de energía necesaria para elevar la temperatura de 1 g de agua de 14,5 °C a 15,5 °C. Hoy en día, la caloría se define en términos del joule:
Ejercicio 1
La etiqueta de un cereal indica que suministra 250 cal.; calcula a cuantos KJ equivalen.
Solución: