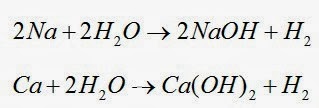Clic Aquí para leer la primera parte de la reacción de desplazamiento
1. Desplazamiento de hidrógeno
Todos los metales alcalinos y algunos metales alcalino-térreos (Ca , Sr , Ba), que son los más reactivos de los elementos metálicos, desplazan al hidrógeno del agua fría.
2. Desplazamiento de metal
Un metal de un compuesto también puede ser desplazado por otro metal en estado libre.
Una forma sencilla de predecir si en realidad va a ocurrir una reacción de desplazamiento de un metal o de hidrógeno, es referirse a una serie de actividad (algunas veces llamada serie electroquímica)
Una serie de actividad es básicamente un resumen conveniente de los resultados de muchas posibles reacciones de desplazamiento a las ya descritas.
De acuerdo con esta serie, cualquier metal que se ubique arriba del hidrógeno lo desplazará del agua o de un ácido, pero los metales situados abajo del hidrógeno no reaccionaran ni con agua ni con ácidos. De hecho, cualquier especie de la serie reaccionará con cualquier otra especie que se encuentre debajo de ella. Por ejemplo, el Zn está arriba del Cu, entonces el zinc metálico desplazará a los iones del cobre.
Las reacciones de desplazamiento de metal tienen muchas aplicaciones en los procesos metalúrgicos, en los cuales interesa separar metales puros a partir de sus minerales. Por ejemplo, el vanadio se obtiene por tratamiento de óxido de vanadio con calcio metálico:
De igual manera, el titanio se obtiene del cloruro de titanio de acuerdo con la reacción:
3. Desplazamiento de halógeno
Los halógenos son los elementos que se encuentran en el grupo VIIA de la tabla periódica.
El comportamiento de halógenos en reacciones de desplazamiento de halógenos se puede resumir en otra serie de actividad:
F2 > Cl2 > Br2 > I2
La fuerza de estos elementos como agentes oxidantes disminuye conforme se avanza del flúor al yodo en el grupo VIIA, así el flúor puede reemplazar a los iones cloruro (ya que tiene mas reactividad).
Las ecuaciones de desplazamiento son:
Las reacciones de desplazamiento de halógeno tienen una aplicación industrial directa. Los halógenos como grupo, son los elementos no metálicos mas reactivos; todos ellos son agentes oxidantes fuertes, en consecuencia se encuentran en la naturaleza en forma combinada (con metales) como halogenuros pero nunca como elementos libres.
De los 4 halógenos, el cloro es con mucho la sustancia química industrial más importante. En 1995 su producción anual fue de 25 millones de libras, con lo cual ocupó el décimo lugar entre los reactivos químicos industriales mas importantes. La producción anual del bromo es de sólo la centésima parte de la del cloro, y la producción de flúor y de yodo es aun menor.
ir a REACCION QUIMICA