La combinación química de un metal y un no metal normalmente da lugar a un compuesto iónico. Un compuesto iónico está formado por iones positivos y negativos unidos por fuerzas electrostáticas de atracción.
Los átomos de los elementos metálicos tienden a perder uno o más electrones cuando se combinan con átomos no metálicos. Los átomos no metálicos tienden a ganar uno o más electrones.
Como resultado de esta transferencia de electrones, el átomo metálico se convierte en un ion positivo, o catión y el átomo no metálico se convierte en un ion negativo, o anión.
Ejemplo de compuesto iónico
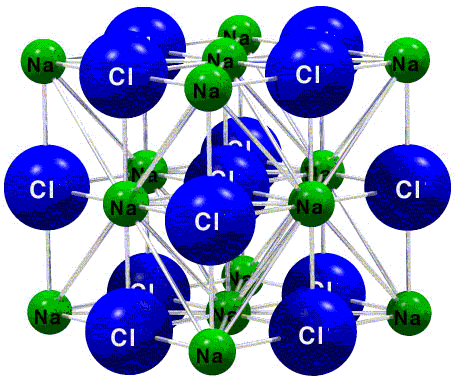
En la formación de cloruro de sodio, sal común, cada átomo de sodio pierde un electrón y se convierte en un ion sodio, Na+, y cada átomo de cloro gana un electrón y se convierte en un ion cloruro, Cl~. Para que el cloruro de sodio sea eléctricamente neutro, se necesita un ion Na+ por cada ion Cl- (+1 - 1 = 0). Así, la fórmula del cloruro de sodio es NaCI y su estructura se muestra en la Figura:
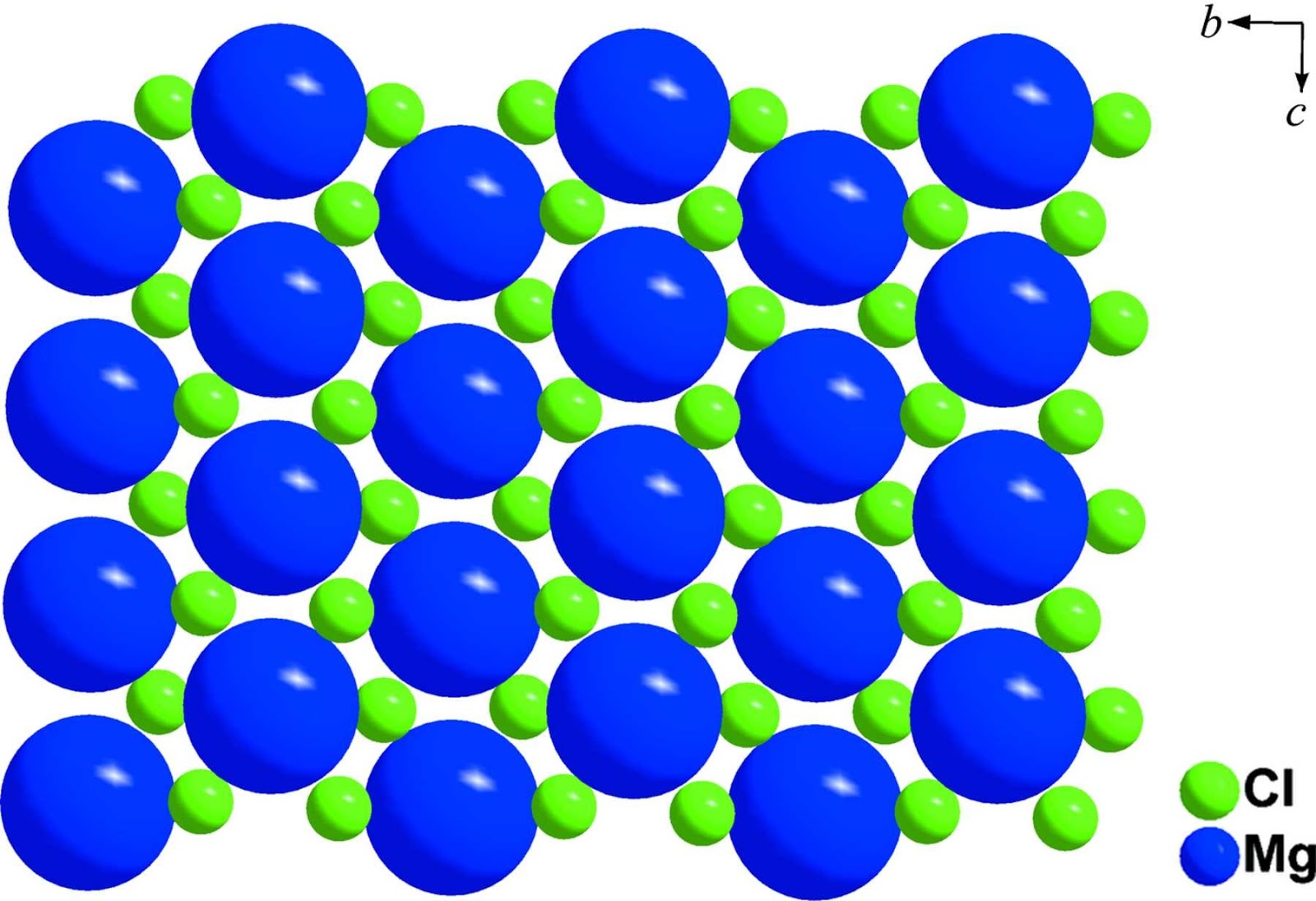
En el cloruro de magnesio que se encuentra en la sal de mesa en concentración de trazas, los átomos de magnesio pierden dos electrones para formar iones magnesio, Mg2+ (el Mg está en el grupo 2). Para obtener una unidad fórmula eléctricamente neutra, necesitamos dos iones Cl-, cada uno con una carga 1—, por cada ion Mg2+. La fórmula del cloruro de magnesio es MgCl2