Los objetos pueden emitir o absorber calor. La emisión o absorción de calor hace que los objetos cambien de temperatura. El cambio de temperatura que un objeto experimenta cuando absorbe cierta cantidad de energía está determinado por su capacidad calorífica. La capacidad calorífica de un objeto es la cantidad de calor necesaria para elevar su temperatura en 1 K (o 1 °C). Cuanto mayor es la capacidad calorífica de un cuerpo, más calor se necesita para producir una elevación de temperatura dada.
En el caso de sustancias puras, la capacidad calorífica suele darse para cierta cantidad de la sustancia. La capacidad calorífica de 1 mol de una sustancia se denomina capacidad calorífica molar. La capacidad calorífica de 1 g de una sustancia es su capacidad calorífica específica, o simplemente su calor específico.
El calor específico de una sustancia se puede determinar experimentalmente midiendo el cambio de temperatura, T, que experimenta una masa conocida, m, de la sustancia cuando gana o pierde una cantidad específica de calor, q:
Ejercicio 1: se requiere 209 J para aumentar la temperatura de 50 g de agua en 1 grado Kelvin de temperatura. Por tanto, el calor específico del agua es:
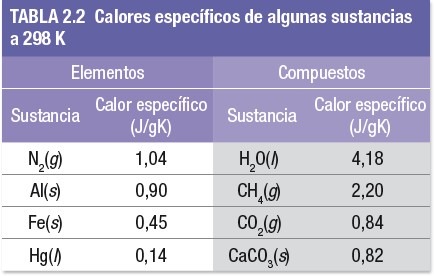
En la Tabla siguiente se dan los calores específicos de varias sustancias. Observa que el calor específico del agua líquida (H2O) es más alto que el de las demás sustancias de la lista. Por ejemplo, es unas cinco veces más grande que el del aluminio metálico. El elevado calor específico del agua afecta el clima de la Tierra porque mantiene la temperatura de los océanos relativamente constante. También es muy importante para mantener una temperatura constante en nuestro cuerpo.