En la vida diaria encontramos muchos metales que reaccionan con el medio ambiente, así la plata se oscurece, el hierro se oxida, el cobre y el bronce forman una capa verde en su superficie; el aluminio se oxida (al menos en una película delgada de óxido de Al, que inhibe la reacción química posterior); el zinc, plomo y aún el acero inoxidable gradualmente pierden su brillo metálico, debido a la corrosión.
Sólo los metales que se encuentran en la parte inferior de la serie de potenciales como el oro y el platino, son inertes a la atmósfera.
Definición de corrosión
Corrosión es el deterioro gradual de las superficies metálicas hacia su interior, por procesos electroquímicos. El proceso de la corrosión, puede ser visto como una tendencia natural de los metales de regresar a su estado original (o demás baja energía y el mas estable). El tipo mas común de corrosión es la oxidación del Fe o el acero, ya que son susceptibles a la corrosión, porque su superficie es químicamente activa y heterogénea.
Comparado con el N2 , O2 y otros componentes atmosféricos, el Fe es un elemento fuertemente electropositivo, por lo tanto sirve de ánodo en donde ocurre la oxidación [O].
El aluminio tiene mas tendencia que el Fe a oxidarse, pero se cubre con un barniz muy fino de Al2O3 que lo protege de la corrosión.
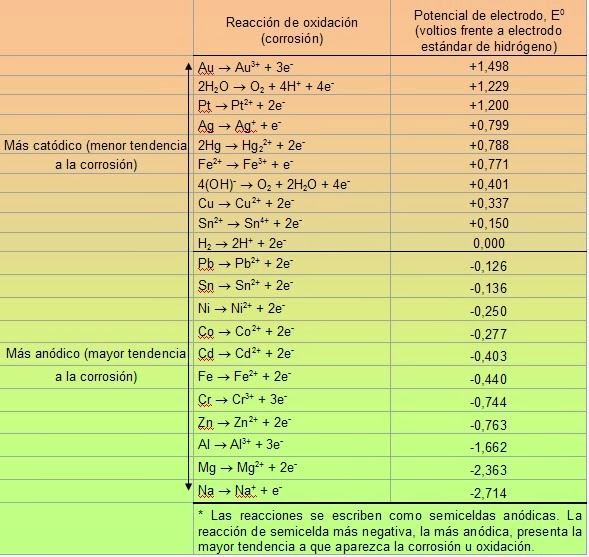
Tabla de Potenciales estándar de reducción a 25°C
Según esta tabla, mientras mayor sea si potencial estándar, menor es su tendencia a la corrosión.