Buen día, seguimos con los talleres de Unidades Químicas de Masa.
Ya saben que tienen que descargarse el formulario, que es con el que trabajaremos esta serie de talleres. Les dejo el link:
Link: Descargar Aquí
1. El número de avogadro (Nav) representa:
a) El número de átomos que hay en una molécula-gramo.
b) El número de moléculas que hay en una molécula-gramo
c) el valor de R (constante universal de los gases) en la ecuación general de los gases
d) El número de Coulombs que atraviesa una celda electrolítica para depositar un equivalente en el cátodo.
e) El número de moléculas que hay en 1 litro de gas a o°C y presión de 1 atm.
Solución:
El número de avogadro (Nav) es igual a 6,023 x 1023 unidades químicas (átomos, moléculas, iones, etc) y la cantidad de sustancia que contenga Nav unidades químicas, es una mol de él.
Para nuestra pregunta: 1 molécula-gramo contiene 6,023 x 1023 moléculas de él.
Clave B.
2. Para conocer el peso de 1 molécula de cierto elemento, debe dividirse entre 6,023 x 1023, el valor correspondiente a la masa de:
a) un átomo-gramo del elemento
b) una molécula-gramo del elemento
c) un gramo del elemento
d) un litro del elemento
e) 22,4 átomo-gramo del elemento
Solución:
Usamos nuestro formulario, y nos centramos en las fórmulas (5) y (6)
Igualamos dichas fórmulas y nos quedaría:
Por dato del problema nos dicen que solo necesitan el peso de una molécula → N°moléculas = 1 ; reemplazando en la fórmula:
Entonces hay que dividir el peso molecular (masa de un mol-g del elementó) entre el número de avogadro (6,022 x 1023)
Clave B
3. ¿Cuál es la masa de un átomo de carbono? . Peso atómico del carbono = 12
Solución:
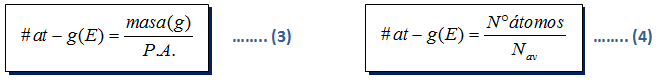
Usamos nuestro formulario, y nos centramos en las fórmulas (3) y (4)
De dato sabemos:
- N° átomos = 1
- Nav = 6,022 x 1023
- P.A. (C) = 12
Igualando las fórmulas (3) y (4)
4. ¿Cuál de los siguientes conceptos son aplicables al mol?
a) Indica el número de partículas
b) Es una determinada cantidad de sustancias
c) Indica una unidad derivada del sistema internacional de unidades
Solución:
a) Verdadero, la mol es un término de conteo de partículas, equivalente a 6,022 x 1023 unidades.
b) Verdadero, esta relacionado con a cantidad de materia (sustancia)
c) Falso, la mol es una unidad fundamental del sistema internacional, de la cantidad de sustancia.
5. Determinar cuantos átomos existen en 9,85 gramos de oro metálico. Dato Peso Atómico oro : 197
Solución:
Usamos nuestro formulario, y nos centramos en las fórmulas (3) y (4)
De datos tenemos:
- masa (g) = 9,85 gr
- P.A (Au) = 197
Igualando las fórmulas:
Recuerden que el valor de Nav = 6,022 x 1023
6. A cuanto equivale el número de átomos contenido en 1 at-gramo de cualquier elemento.
Solución:
Usamos la fórmula 4:

Si quiere agregar una pregunta sobre Unidades químicas de masa, haga clic en el siguiente Link:
Ingresar Pregunta de Unidades Químicas de masa Aquí