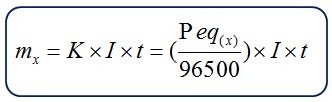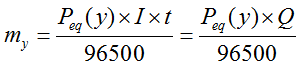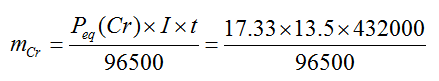En 1834 Michael Faraday estudió las relaciones cuantitativas entre la cantidad de corriente eléctrica que se usa en la electrolisis, y el volumen de la reacción que produce.
En 1874 Stoney expuso que la unidad natural de electricidad, podría ser tomada como la carga que libera por electrolisis un átomo de una sustancia monovalente, llamándole a esta unidad de electricidad “electrón” y en 1891 predijo la cantidad de electricidad de la misma.
Intensidad de corriente (I): Es la cantidad de carga eléctrica (Q) que fluye en un intervalo de tiempo (t).
Donde las unidades:
- I: Amperes (A)
- Q: Coulomb (C)
- t: segundos (s)
Faraday (F): Representamos la cantidad de carga de un mol de electrones, la cual es capaz de descomponer o producir 1 Eq-g de una cierta sustancia.
donde my : sustancia depositada o liberada en los electrones.
1ra Ley de Faraday
“La cantidad de sustancia que libera o se deposita en un electrodo es proporcional a la cantidad de electricidad que pasa por la celda electrolítica”
Donde:
- mx = masa depositada o liberada (gramos)
- K = constante o equivalente electroquímico
- Peq = peso equivalente de la sustancia que se deposita o libera
2da Ley de Faraday
Es una generalización de la 1ra ley: “Si varias cubas electrolíticas, conectadas en serie, conteniendo sendas soluciones electrolíticas, son atravesadas por la misma cantidad de electricidad, entonces los pesos de las sustancias depositadas o liberadas en los electrodos, son proporcionales a los pesos equivalentes de las respectivas sustancias.”
Conclusión: Las 3 masas de la plata (Ag), cobre (Cu) y aluminio (Al) depositados en los cátodos, serán proporcionales a sus respectivos pesos equivalentes.
Donde:
- W(x) : peso o masa (gramos)
- Peq(x) : peso equivalente
Ejemplo de electrolisis
1. Se electroliza una solución de Cr+3 , empleando una corriente de 13.5 A. ¿Qué masa de Cr se habrá depositado después de 5 días de la electrolisis?. Dato: Peso molecular del cromo = M(Cr) = 52.
Solución:
La reacción de reducción en el cátodo es:
Como los electrones transferidos son 3, entonces θ = 3
Usando la fórmula del equivalente gramo:
Usando la primera ley de Faraday:
Reemplazando tenemos:
Peq(Cr) = 17.33
I = 13.5 A
t = 5 dias = 432000 seg