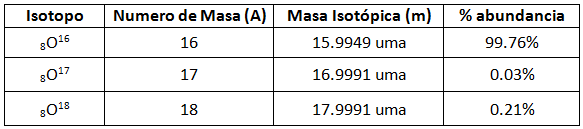
Se debe recordar que un elemento químico es una mezcla de sus isótopos. Tomemos como ejemplo al elemento oxígeno:
La masa atómica relativa de un isotopo se llama masa isotópica, se mide en un aparato llamado espectrómetro de masas, para ello se fija convencionalmente una unidad, llamada unidad de masa atómica (UMA), que viene a ser la doceava (1/12) parte de la masa del átomo de carbono – 12.
C12 : pesa 12 umas
1 uma = (1/12) masa C12
Equivalencia:
1 uma = 1.66 x 10-24 gramos.
El espectrómetro de masas, además de indicar la masa atómica relativa de los isótopos de un elemento, indica la abundancia de cada isótopo.
¿Qué diferencia hay entre número de masa (A) y masa isotópica (m)?
El número de masa siempre es un número entero (A = número de protones + número de neutrones), mientras que la masa isotópica es un número decimal y se expresa en UMA.
Los cálculos matemáticos, ¿con qué masa isotópica se realizan? ¿con la del isótopo mas abundante? ¡No!, se realizan con la masa atómica promedio, llamada comúnmente como “peso atómico” (PA)