La masa de un átomo es igual a la suma de protones y neutrones (ver fórmula).

Sin embargo, los átomos de algunos elementos no tienen la misma masa debido a la diferencia en el número de neutrones dentro del núcleo.
Isótopos
Los átomos de un mismo elemento con diferente masa se llaman isótopos. En los isótopos, el número de electrones y protones es el mismo, pero el número de neutrones es diferente, lo cual significa que el número atómico (Z) es el mismo, pero la masa atómica (A) es diferente.
Abundancia de los isótopos
Los isótopos de un mismo elemento no abundan del mismo modo en la naturaleza, unos están presentes en mayor cantidad que otros.

Masa atómica promedio
Para un elemento que tenga varios isótopos, se requiere calcular la masa atómica promedio.
En la tabla periódica se reportan las masas atómicas promedios, que dependen de la abundancia de los diferentes isótopos de cada elemento.

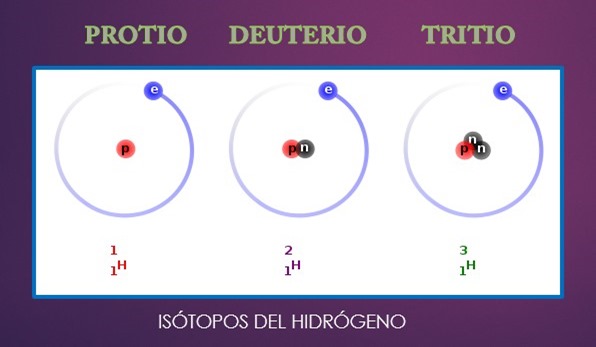
Sobre el isótopo del hidrógeno
En la naturaleza se encuentran tres isótopos del hidrógeno, de los cuales el protio y el deuterio son los mas abundantes y se diferencia por un neutrón en su núcleo.
Algunas aplicaciones de los isótopos
Los isótopos se aplican como trazadores que contribuyen en el conocimiento de procesos naturales, industriales y mineros. Se utiliza por ejemplo, para determinar la velocidad de un fluido y para detectar filtraciones o bloqueos en tuberías subterráneas o embalses.
El cobalto – 65 es un emisor de rayos gamma que se utiliza para destruir células cancerígenas, el haz de la luz infrarroja se orienta directamente al tumor.
El iodo – 131 se utiliza para tratar el cáncer de tiroides. El paciente debe ingerirlo.
El iodo – 123 es un emisor de rayos gamma, se utiliza para obtener imágenes de las tiroides