Una fórmula química nos informa cualitativamente y cuantitativamente sobre la estructura interna de una sustancia química pura.
En forma cualitativa nos informa qué elementos forman a la sustancia. Por ejemplo, la fórmula del agua: (H2O), nos señala que el agua está formada sólo por dos elementos (es binaria): hidrógeno y oxígeno.
En el aspecto cuantitativo, podremos interpretar una fórmula bajo dos puntos de vista: como una partícula estructural y como una unidad química de masa (mol-gramo o fórmula-gramo)
En este aspecto veamos a manera de ejemplo ilustrativo con la fórmula del ácido sulfúrico.
a) Como partícula, representa una molécula o una unidad fórmula.
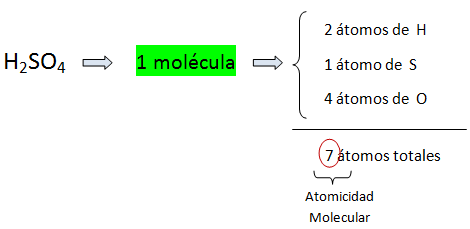
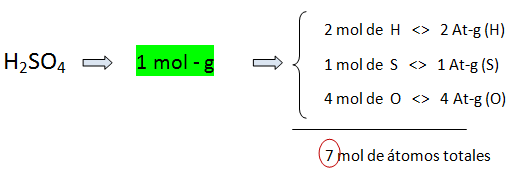
b) Como masa, representa un mol-g o peso fórmula gramo. En este casi los subíndices indican el número de moles de átomos o números de átomos – gramos de cada elemento.
Aplicaciones
Ejemplo 1.
En 20 moles de ácido fosfórico, H3PO4 ¿Cuántas moles de hidrógeno hay, y cuantos at-g de oxígeno hay?
Solución:
Primero hacemos nuestro esquema:
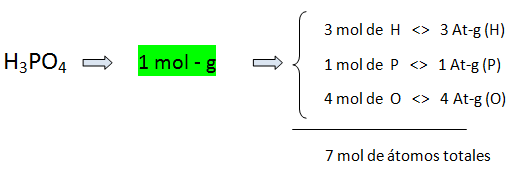
Interpretando como masa, para calcular las moles de hidrógeno presentes en 20 moles de H3PO4:
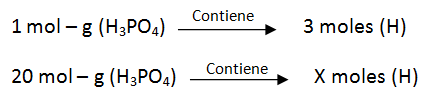
X = 20 x 3 = 60 moles de H
En 20 moles de H3PO4 hay 60 moles de H
Para calcular los at-g de oxígeno presentes en 20 moles de H3PO4
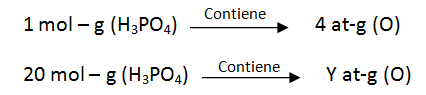
Y = 20 x 4 = 80 at - g de O
En 20 moles de H3PO4 hay 80 at-g de O
Ejemplo 2.
En 50 moléculas de glucosa, C6H12O6 ¿Cuántos átomos de carbono hay, y cuántos átomos de hidrógeno?
Solución:
Hay 300 átomos de carbono
Hay 600 átomos de hidrógeno.
1 comentarios publicado
Excelente explicacion!